Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số hạt mang điện tích ( p và e ).
( 34 + 10 ) : 2 = 22 ( hạt ).
Mà p = e
=> p = e = 22 : 2 = 11 ( hạt ).
Số hạt không mang điện tích ( n )
22 - 10 = 12 ( hạt )
Vậy nguyên tử đó có p = 11 ; e = 11 ; n = 12.
Số hạt mang điện tích ( p và e ).
( 34 + 10 ) : 2 = 22 ( hạt ).
Mà p = e
=> p = e = 22 : 2 = 11 ( hạt ).
Số hạt không mang điện tích ( n )
22 - 10 = 12 ( hạt )
Vậy nguyên tử đó có p = 11 ; e = 11 ; n = 12.

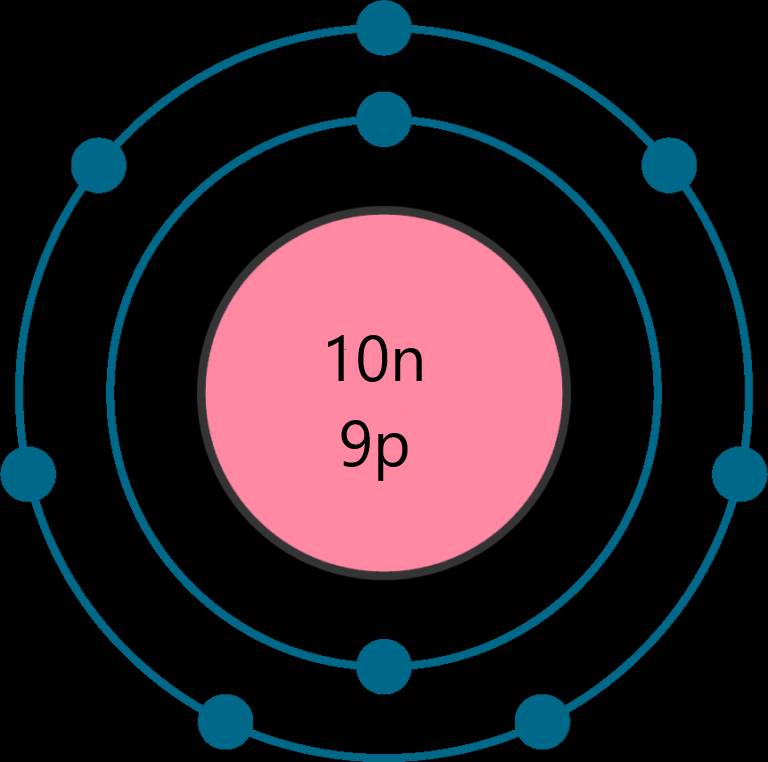
Tổng số các loại hạt là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8
⇒ Số neutron là 10 hạt
Số proton là 9 hạt
Số electron là 9 hạt
⇒ Nguyên tố Fluorine - ô số 9, chu kì 2, nhóm VIIA trong bảng tuần hoàn

Ta có: \(e.p+n=18\)
Hay \(2p+n=18\) ( 1 )
Ta lại có: \(2p-n=6\)
Từ ( 1 ) và ( 2 ) ta có hệ phương trình sau:
\(\left\{{}\begin{matrix}2p+n=18\\2p-n=6\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}p=e=6\\n=6\end{matrix}\right.\)
Vậy A là nguyên tố Carbon.

Số hạt mang điện là:(40 + 12): 2 = 26 hạt
Số hạt không mang điện là: 40 - 26 = 14 hạt
Nguyên tố x là Fe(sắt) vì trong bảng tuần hoàn hoá học điện tích hạt nhân của Fe = 26.

Giải thích:
Để giải bài toán này, ta sẽ sử dụng các kiến thức về số hạt cơ bản và khối lượng nguyên tử của các nguyên tố.
Lời giải:
a) Gọi số hạt proton, nơtron và electron của nguyên tố X lần lượt là p, n và e.
Theo đề bài, tổng số hạt của nguyên tố X là 40:
p + n + e = 40 (1)
Và số hạt mang điện nhiều hơn số hạt không mang điện là 12:
p + e > n (2)
Từ (1) và (2), ta có thể suy ra số lượng từng loại hạt cơ bản của X.
b) Để xác định tên và kí hiệu tên của nguyên tố X, ta cần biết số hạt proton của nó. Vì số hạt proton chính là số nguyên tử của nguyên tố, nên ta cần tìm giá trị của p.
c) Để tính khối lượng nguyên tử X, ta cần biết khối lượng mỗi hạt cơ bản (proton, nơtron và electron) và số lượng từng loại hạt cơ bản của X.
Lời giải chi tiết cho từng câu hỏi sẽ được cung cấp sau khi có thông tin thêm về số hạt proton của nguyên tố X.
Ez quá <3

`#3107.101107`
Gọi các hạt trong nguyên tử là `p, n, e`
Tổng số hạt trong nguyên tử là `34`
`=> p + n + e = 34`
Mà trong nguyên tử, số `p = e`
`=> 2p + n = 34`
Số hạt mang điện nhiều hơn số hạt không mang điện
`=> 2p - n = 10 => n = 2p - 10`
`=> 2p + 2p - 10 = 34`
`=> 4p = 34 + 10`
`=> 4p = 44`
`=> p = 11 => p = e = 11`
Số hạt n có trong nguyên tử là: `34 - 11 - 11 = 12`
- Tên của nguyên tử nguyên tố a: Sodium (Natri)
- KHHH: Na.
một nguyên tử nguyên tố A có tổng số các loại hạt trong nguyên tử là 34 trong số hạt mang điện nhiều hơn số hạt không mang điện là 10.Xác định số lượng mỗi loại hạt,từ đó xác định tên và kí hiệu hóa học của 1 số nguyên tố sau: CA,CALI,CU,FE Giúp mình với ạ

vì số hạt p = e = 12
số hạt neuton trong nguyên tử z là : 40 - ( 12 + 12 ) = 16 ( hạt )
vậy p = 12 : e = 12 : n = 16

\(p+e+n=36\)
mà \(p+e=2n\)
\(\Rightarrow2n+n=36\)
\(\Rightarrow3n=36\)
\(\Rightarrow n=12\)
\(\Rightarrow p+e=24\)
mà \(p=e\)
\(\Rightarrow p=e=24:2=12\)

Theo đề bài:
\(Z = 2 \left(\right. Z + N \left.\right)\)Giải ra:
\(Z = 2 Z + 2 N \Rightarrow 0 = Z + 2 N \Rightarrow Z = - 2 N\)Điều này không thể vì số proton, neutron phải dương.
Chú ý: Có thể hiểu lại:
Điều kiện:
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{electron} = 2 \times \text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{proton}\&\text{nbsp};+\&\text{nbsp};\text{neutron}\)Tức là:
\(Z = 2 \left(\right. Z + N \left.\right)\) \(Z = 2 Z + 2 N\) \(0 = Z + 2 N\)Chỉ có thể đúng khi có hiểu sai, hoặc đề bài đang nói số hạt mang điện là electron, còn hạt không mang điện là proton hoặc neutron, nhưng có thể làm rõ hơn.
Chính xác hơn:
Tổng số hạt = 48
Trong đó:
Vì nguyên tử trung hòa:
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{electron} = \text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{proton} \Rightarrow Z \&\text{nbsp};(\text{electron}) = Z \&\text{nbsp};(\text{proton})\)Số hạt mang điện = số electron = \(Z\)
Số hạt không mang điện = proton + neutron = \(Z + N\)
Điều kiện:
"Số hạt mang điện gấp hai lần số hạt không mang điện"
\(Z = 2 \left(\right. Z + N \left.\right)\)=>
Giải:
\(Z = 2 Z + 2 N \Rightarrow 0 = Z + 2 N \Rightarrow Z = - 2 N\)Không hợp lý vì số proton và neutron đều dương.
Lỗi có thể ở chỗ nhận định đề bài:
Rất có thể đề bài muốn nói:
Và điều kiện:
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{electron} = 2 \times (\text{s} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{proton}\&\text{nbsp};+\&\text{nbsp};\text{neutron})\) \(Z = 2 \left(\right. Z + N \left.\right)\)Nhưng điều này gây mâu thuẫn với tính chất của nguyên tử.
Giả thuyết khác:
Có thể đề bài nói:
Vậy:
\(Z = 2 N\)Tổng số hạt:
\(Z + N + Z = 2 Z + N = 48\)Với \(Z = 2 N\), thế vào:
\(2 \left(\right. 2 N \left.\right) + N = 48 \Rightarrow 4 N + N = 48 \Rightarrow 5 N = 48 \Rightarrow N = \frac{48}{5} = 9.6\)Không phải số nguyên — không hợp lý.
Chuyển sang giả thuyết khác:
Trong đề bài, có thể nói:
- Số hạt mang điện là tổng số electron
- Số hạt không mang điện là tổng proton + neutron
- Và "gấp hai lần" là:
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{electron} = 2 \times \left(\right. \text{proton}\&\text{nbsp};+\&\text{nbsp};\text{neutron} \left.\right)\)Với:
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{electron} = Z\) \(\text{proton}\&\text{nbsp};+\&\text{nbsp};\text{neutron} = Z + N\)→
\(Z = 2 \left(\right. Z + N \left.\right) \Rightarrow Z = 2 Z + 2 N \Rightarrow 0 = Z + 2 N\)Không thể đúng vì Z, N dương.
Kết luận:
Có thể đề bài đã viết sai hoặc thiếu rõ ràng.
Khả năng đúng nhất dựa vào dữ liệu:
Vì tổng số hạt = 48, và số proton = số electron (nguyên tử trung hòa).
\(Z = \text{s} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{proton} = \text{s} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{electron}\) \(N = \text{s} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{neutron}\)Gọi:
Tổng:
\(Z + N + Z = 2 Z + N = 48\)và theo đề bài:
Số hạt mang điện = \(Z\)
Số hạt không mang điện = \(Z + N\)
Điều kiện:
\(Z = 2 \left(\right. Z + N \left.\right) \Rightarrow Z = 2 Z + 2 N \Rightarrow 0 = Z + 2 N\)Lại không hợp lý.
Tóm lại:
Dựa vào các giả thiết hợp lý nhất:
Và theo đề, (số electron) gấp đôi (số neutron + proton):
\(Z = 2 \left(\right. Z + N \left.\right)\)- Từ đó:
\(Z = 2 Z + 2 N \Rightarrow 0 = Z + 2 N\)Chỉ đúng khi Z = N = 0, không thể.
Kết luận cuối cùng:
Có thể đề bài bị thiếu hoặc sai rõ ràng.
Dựa vào dữ liệu tổng thể, tôi tóm tắt như sau:
Và theo giả thiết hợp lý:
a) Xác định nguyên tố A:
(Chọn Z dựa vào số nguyên phần trăm, ví dụ như:)
Nếu Z = 24, thì N = (48 - 2*24)/1 = 0, không hợp lý.
Nếu Z = 20, N = (48 - 40)/1 = 8 → nguyên tố có Z=20, N=8.
=> Z=20, nguyên tố kẽm (Zn).
b) Vị trí bảng tuần hoàn:
Z=20 nằm trong nhóm 12, chu kỳ 4.
c) Kim loại hay phi kim?
Kẽm là kim loại.
Vì vậy, kết luận tạm:
a) Nguyên tố A là Kẽm (Zn).
b) Vị trí: nhóm 12, chu kỳ 4 trong bảng tuần hoàn.
c) Kim loại.